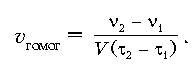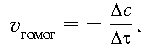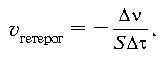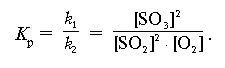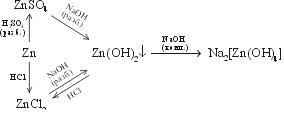Ю.И.ПАХОМОВCборник
|
| Особенности реакций | Примеры | Теоретическое обоснование |
|---|---|---|
| Природа реагирующих веществ | Металлы (K, Na) с водой реагируют с различной скоростью | Атомы металлов K и Na отдают
электроны (окисляются) с разной скоростью, т. к. RK
> RNa (R – радиус атома) |
| Для гомогенных процессов скорость химической реакции зависит от концентрации реагирующих веществ | Горение вещества в чистом кислороде активнее, чем в воздухе | Частота столкновений
молекул реагирующих веществ зависит от их числа в единице объема, т. е. от концентрации |
| Для веществ в твердом
состоянии скорость реакции прямо
пропорциональна поверхности соприкосновения реагентов |
Вещества железо и сера в твердом состоянии реагируют достаточно быстро лишь в измельченном виде и при перемешивании | При измельчении и перемешивании увеличивается поверхность соприкосновения реагирующих веществ |
| При повышении
температуры на каждые 10° скорость большинства
реакций увеличивается в 2–4 раза правило Вант-Гоффа):
|
Со многими веществами кислород начинает реагировать с заметной скоростью уже при обычной температуре (медленное окисление), а при повышении температуры скорость окисления резко увеличивается | Для химической реакции взаимодействующие молекулы должны быть активны (обладать достаточной кинетической энергией). При повышении температуры доля активных молекул возрастает |
| Скорость химической
реакции зависит от присутствия катализатора (или
ингибитора): A + K AK + В |
Разложение бертолетовой соли (KClO3) и пероксида водорода (H2O2) ускоряется в присутствии МnО2. В присутствии ингибиторов соляная кислота становится инертной к металлам | В присутствии
катализаторов молекулы, как правило, становятся
реакционноспособными при более низкой
температуре. Реакционная способность KClО3
проявляется при 400 °С, а в присутствии МnO2 – при 200 °C |
| В две пробирки
положить по грануле цинка и прилить: в первую
– 2 мл разбавленной соляной кислоты (1:2), а во вторую – 2 мл разбавленной уксусной кислоты (1:2) |
Учитывая силу кислот
и, следовательно, разную концентрацию ионов
гидроксония (Н3О+) в их растворах,
объяснить различную скорость выделения
свободного водорода (Н2 |
….. |
| В одну пробирку насыпать немного порошка железа, в другую – столько же железных стружек и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2) | Объяснить причину большей скорости выделения пузырьков газа при взаимодействии кислоты с восстановленным железом (порошком) | ..... |
| В две пробирки положить по 2 гранулы цинка:в первую – прилить 2 мл разбавленной серной кислоты (1:5), а во вторую – раствор H2SO4 (l:10) | Что наблюдается? Объяснить большую скорость взаимодействия в одном из опытов |
..... |
| В две пробирки положить по 2
гранулы цинка и в обе прилить по 2 мл разбавленной
серной кислоты (1:10). Одну из пробирок слегка подогреть |
Сравнить результаты
наблюдений, объяснить причину различной скорости химической реакции. Kаким образом можно увеличить скорость реакции без нагревания? |
….. |
Практическая работа 10.
Химическое равновесие
и условия его смещения
Цель. Закрепить понятия о химическом
равновесии и условиях его смещения.
Оборудование и реактивы. Спиртовка,
спички, водяная баня, газоотводная
трубка-капилляр, штатив с пробирками, держатель
для пробирок, санитарная склянка; хлорид натрия
(р-р) и хлорид натрия (крист.), карбонат натрия (р-р)
и карбонат натрия (крист.), известковая вода (Са(ОН)2),
лакмус (p-p), метилоранж (р-р), едкий натр (р-р), H2SO4
(разб.), H2SO4 (конц.).
Необратимых реакций нет, любой процесс, рассматриваемый как необратимый, может быть превращен в обратимый (и наоборот). Разложение карбоната кальция:
![]()
Реакция необратима, если она осуществляется в открытой системе (т. е. где из сферы реакции возможно улетучивание оксида углерода(IV)). Однако в замкнутой системе процесс идет не полностью. Когда в системе устанавливается определенное давление газа, препятствующее разложению, процесс становится обратимым. Для обратимой реакции, записываемой в общем виде:
aA + bB = cC + dD,
скорость прямой реакции ![]() пр определяется из
соотношения:
пр определяется из
соотношения:
![]()
где k1 – константа скорости прямой реакции, cA и cB – молярные концентрации веществ А и В.
Концентрации веществ А и В уменьшаются, и,
следовательно, скорость прямой реакции
понижается. Появление в системе продуктов С и D
означает возможность протекания обратного
процесса, скорость которого ![]() обр математически
выражается следующим образом:
обр математически
выражается следующим образом:
![]()
По мере накопления в системе веществ С и D
скорость обратного процесса непрерывно
возрастает до выравнивания скоростей прямой и
обратной реакций: ![]() пр =
пр = ![]() обр. Подобное состояние
системы называется химическим равновесием.
обр. Подобное состояние
системы называется химическим равновесием.
Соотношение между концентрациями при равновесии выражается формулой:
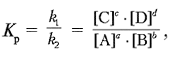
где Kp – константа равновесия, [A], [B],
[C], [D] – равновесные концентрации веществ.
Величина константы химического равновесия
зависит от природы реагирующих веществ и от
температуры. Если Kp > 1, то ![]() пр >
пр > ![]() обр, если Kp
< 1, то
обр, если Kp
< 1, то ![]() пр
<
пр
< ![]() обр.
обр.
Смещение равновесия в зависимости от изменения
условий определяется универсальным принципом Ле
Шателье:
если на систему, находящуюся в состоянии
химического равновесия, оказывать воздействие,
выражающееся в изменении концентрации,
температуры или давления, то равновесие
смещается в направлении, способствующем
ослаблению этого воздействия.
Пример 1. Почему лакмус (HInd) в кислой среде (избыток H3О+) – красный, а в щелочной (избыток гидратированного ОН–, рН > 7) – cиний?
Решение
Уравнение диссоциации индикатора можно представить в виде:
HInd
Н+ + Ind–.
В состоянии химического равновесия:
1) При избытке в растворе гидратированного Н+ (кислая среда, рН < 7) Кр < 1. Химическое равновесие сдвигается в сторону обратной реакции, т. е. в растворе накапливаются недиссоциированные молекулы индикатора красного цвета.
2) Избыток ОН– (щелочная среда, рН > 7) нейтрализует ионы гидроксония, т. е. уменьшает их концентрацию, что сдвигает равновесие вправо (Кр > 1), в сторону накапливания гидратированных анионов индикатора синего цвета Ind–.Пример 2. Вывести математическое выражение Кр для реакции:
2SO2 + O2 = 2SO3 + Q.
Используя численное значение Кр и принцип Ле Шателье, объяснить, как можно предсказать сдвиг равновесия вправо.
Решение
Сместить равновесие вправо можно с помощью следующих воздействий.
1) Увеличить концентрацию реагирующих веществ. Такое воздействие можно описать неравенством:
Число молекул SO2 и O2 в единице объема увеличивается, столкновения между ними становятся чаще, как следствие, концентрация SO3 тоже возрастает.
2) Уменьшить концентрацию продукта реакции. При уменьшении концентрации (отводе) SO3 результат подобен предыдущему. Новые порции исходных веществ будут реагировать для компенсации удаляемого продукта.
3) Понизить температуру. Прямая реакция – экзотермическая, поэтому для сдвига равновесия вправо систему следует охлаждать. Потерянное тепло будет восполняться вследствие усиления прямой реакции. (Наоборот, повышение температуры вызовет сдвиг равновесия влево.)
4) Повысить давление. Исходные вещества – газообразные, продукт – жидкое вещество (в виде пара). Прямая реакция идет с уменьшением объема, следовательно, увеличивая давление, мы смещаем равновесие вправо, а уменьшая – влево. Если бы реакция шла без изменения объема, то изменение давления не влияло бы на равновесие.
5) Использование катализатора не вызывает смещения равновесия. Катализатор, заметно влияющий на скорость химической реакции, равно ускоряет обе реакции – прямую и обратную.
Применение обратимых процессов в промышленности невыгодно, т. к. слишком мал практический выход продукта реакции. На практике стараются подобрать оптимальные условия для этих реакций, чтобы как можно больше сместить равновесие в нужную сторону.
| Порядок работы | Задания | Наблюдения и выводы |
|---|---|---|
| Испытать растворы щелочи и кислоты раствором метилового оранжевого | Объяснить с точки зрения принципа Ле Шателье изменение окраски индикатора (HInd) в нейтральной, кислой и щелочной средах. Kакие факторы и как влияют на сдвиг равновесия? Показать на схеме и в расчете согласно основному закону химической кинетики (закон действующих масс) |
..... |
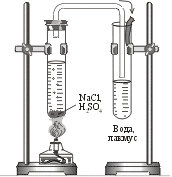
| Собрать два одинаковых
прибора согласно схеме. В реакторе первого смешать разбавленные водные растворы хлорида натрия и серной кислоты, в реакторе второго – кристаллический хлорид натрия и концентрированную серную кислоту H2SО4. Газоотводную трубку в приемниках (сборниках) поместить над водой, одкрашенной лакмусом. Обе смеси подогреть
|
Объяснить, почему в первом реакторе нет изменений, характеризующих ход химической реакции, а во втором таковые есть. Kакие они? Указать причины сдвига равновесия, записать уравнения реакций происходящих процессов | ….. |
| Используя два прибора,
как и в предыдущем опыте, проверить
взаимодействие сильно разбавленного раствора
карбоната натрия с серной кислотой и
кристаллической соли с концентрированной H2SO4. B сборник под газоотводную трубку поместить известковую воду. Смеси нагреть |
Составить уравнения
реакций происходящих процессов и объяснить разницу в наблюдаемых признаках, причины сдвига равновесия и увеличения скорости прямой реакции |
….. |
| Использовать схему ответа, аналогичную рассмотренной в предыдущих примерах | Вывести
математическое выражение Kp для
реакции: 2H2S + 3О2 = 2Н2О + 2SО2 + Q. Объяснить на основании Kp и принципа Ле Шателье условия сдвига равновесия вправо |
.... |
Практическая работа 11.
Решение экспериментальных задач по теме
«Подгруппа кислорода»
Цель. Обобщить знания о свойствах
соединений элементов подгруппы кислорода.
Оборудование и реактивы. Центрифуга,
выпаривательная чашечка, шпатель, штатив
железный с кольцом, спиртовка, спички, штатив с
химическими пробирками, санитарная склянка,
стеклянная трубка; растворы хлорида натрия,
сульфата натрия и серной кислоты в пробирках №
1–3 (3 варианта), лакмус, рacтвop AgNO3 в HNO3,
водные растворы BaCl2, сульфата меди(II), Ba(NO3)2,
NaCl, CaCl2, CuCl2, растворы йодида, хлорида,
бромида, сульфата калия в пробирках № 4–7 (3
варианта), хлорная вода (Cl2), крахмал, цинк
(гранулы), серная кислота (разб.), соляная кислота
(разб.), щeлoчь NaOH (разб. и конц.).
| Порядок работы | Задания | Наблюдения и выводы |
|---|---|---|
| Опытным путем определить, в каких из трех пронумерованных (№ 1, 2, 3) пробирок находятся растворы сульфата, хлорида натрия и серной кислоты | 1) Пробы растворов
испытать лакмусом. Обосновать, почему растворы солей не изменяют окраску индикатора. 2) K пробам растворов солей добавить по 2–3 капли раствора хлорида бария. Проверить выпавший осадок на растворимость в кислотах, описать его. Составить уравнения реакций. 3) Пробу оставшегося раствора проверить добавлением 2–3 капель раствора нитрата серебра в HNO3. Составить соответствующее уравнение реакции. Почему сначала нужно проводить проверку раствором BaCl2, а не AgNO3? 4) Сделать вывод о полученных результатах определения |
….. |
| Из раствора сульфата меди(II) получить раствор хлорида меди(II) | 1) K пробе раствора
сульфата меди(II) добавить, взбалтывая, раствор
хлорида бария. Объяснить наблюдаемое. Написать молекулярное и ионные уравнения реакции. 2) Осадок отцентрифугировать и отделить. Сделать вывод об остаточном растворе |
..... |
| Определить с помощью
характерных реакций водные растворы йодида,
хлорида, бромида и сульфата калия в четырех
пронумерованных (№ 4–7) пробирках |
1) Пробы вcex четырех
pacтворов испытать хлорной водой (Cl2). В каких пробах и какие произошли изменения? Добавить 2–3 капли этих продуктов на крахмал. Что наблюдается? Записать на основе электронного баланса молекулярные и ионные уравнения, сделать вывод. |
..... |
|
2) Две оставшиеся пробы
испытать 2–3 каплями раствора BaCl2 или Ва(NO3)2. Что наблюдается? Описать наблюдения. Испытать продукт на растворимость в кислотах. Записать уравнения реакций, сделать вывод. 3) Оставшуюся пробу проверить раствором нитрата серебра в HNO3. Составить уравнение реакции. 4) Сделать общий вывод о полученных результатах определения веществ |
….. |
| Проделать опыты по
осуществлению следующих превращений:
|
Записать последовательно уравнения реакций | ..... |
| Проверить опытным путем,
реагирует ли разбавленная серная кислота с
цинком, растворами Ba(NO3)2, NaCl, CaCl2, CuCl2 |
Написать уравнения реакций. Kакая из них является окислительно-восстановительной? | ….. |