Ю.П.ПАХОМОВCборник
|
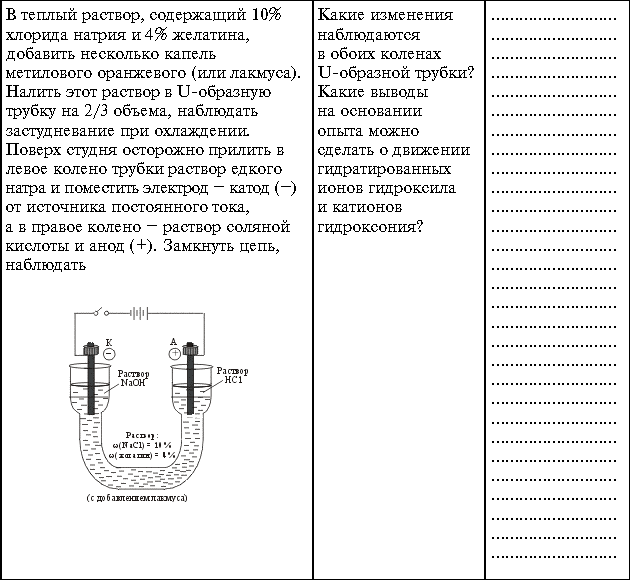
| NaOH |
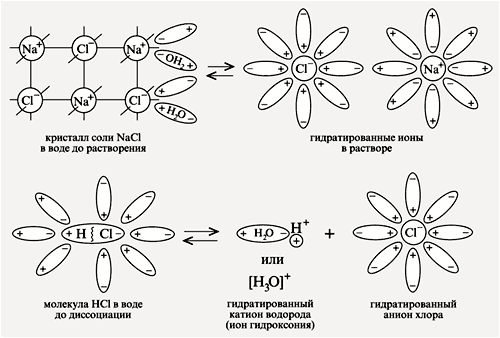
Гидpaтированныe анионы
гидроксильных групп, двигаясь к аноду, окрашивают нейтральный (фиолетового цвета) лакмус в синий цвет. |
| HCl |
Катионы гидроксония H3O+,
двигаясь к катоду, окрашивают лакмус в красный цвет. |
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
![]()

*Здесь и далее в графе «Наблюдения и выводы» записать результаты работы: что делали, что наблюдали и выводы.
Практическая работа 2.
Свойства ионов.
Степень диссоциации
Цели. Обобщить сведения о свойствах
ионов, закрепить понятие о степени диссоциации.
Оборудование и реактивы. Чашка для
выпаривания, шпатель, пробирки № 1–6, штатив с
кольцом, спиртовка, спички, санитарная склянка;
на демонстрационном столе растворы: NaCl, KCl, Na2SO4,
CuCl2, FeSO4, Fe2(SO4)3, Cr2(SO4)3,
CuSO4, Ni(NO3)2, MnCl2, KMnO4, K2Cr2O7,
NH4NO3, (NH4)2Cr2O7,
Ca(NO3)2, Ca(OH)2, Ba(OH)2, NaOH, CoCl2,
CuCl2 (безводн.), Н2О (дист.), Mg (порошок, 6
навесок по 1 г), раствор HCl (![]() = 1,19 г/см3), раствор СH3СООН (
= 1,19 г/см3), раствор СH3СООН (![]() = 80%).
= 80%).
![]()
где ![]() – степень
диссоциации;
– степень
диссоциации;
n – число диссоциированных молекул;
N – общее число молекул вещества в растворе.
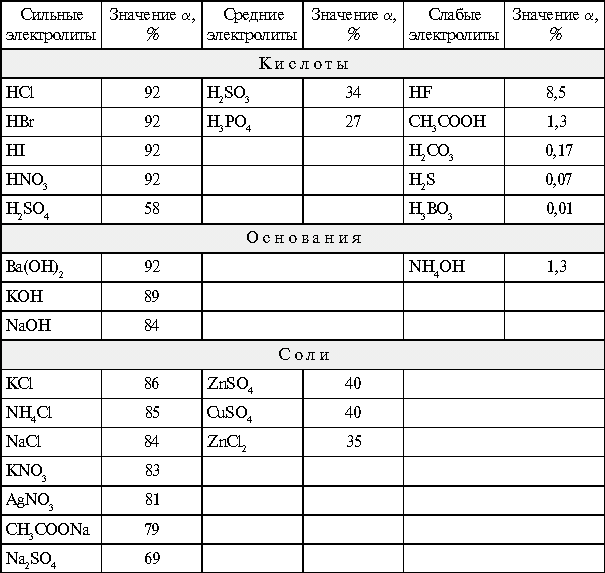
Для 0,1н. растворов электролитов при 18 °С
значения степени диссоциации ![]() приведены в табл. 1.
приведены в табл. 1.
Таблица 1
Степени диссоциации ![]() 0,1н.
растворов электролитов при 18 °С
0,1н.
растворов электролитов при 18 °С
Для диссоциации электролита AB:
AB ![]() A+ + B–.
A+ + B–.
константа диссоциации Kдис более
точно характеризует силу электролита, чем
степень ![]() .
.
![]()
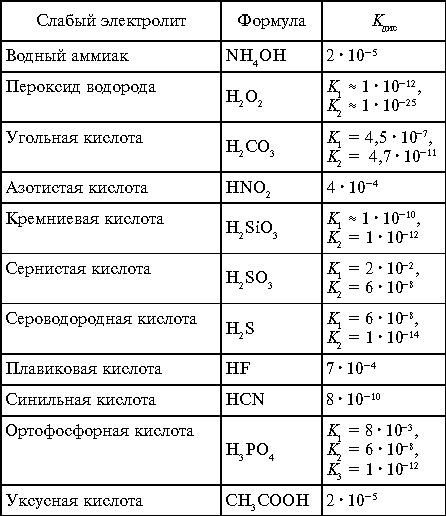
Если диссоциация электролита ступенчатая, то для каждой ступени выводится своя Kдис (табл. 2).
Таблица 2
Константы диссоциации слабых
электролитов
в водных растворах при 25 °С
Задание 1. Рассмотреть представленные на демонстрационном столе водные растворы веществ. Заполнить таблицу.

Задание 2. Привести примеры окрашенных растворов веществ и указать, какими гидратированными ионами обусловливается их окраска.
БЕСЦВЕТНАЯ NaNO3 (Na+ – б/цв., ![]() – б/цв.),
– б/цв.),
...................................................................................................
СИНЯЯ
...................................................................................................
РОЗОВАЯ
...................................................................................................
ЗЕЛЕНАЯ
...................................................................................................
ЖЕЛТАЯ
...................................................................................................
САЛАТОВАЯ
...................................................................................................
ФИОЛЕТОВАЯ
...................................................................................................
ОРАНЖЕВАЯ
...................................................................................................
ЖЕЛТО-БУРАЯ
...................................................................................................
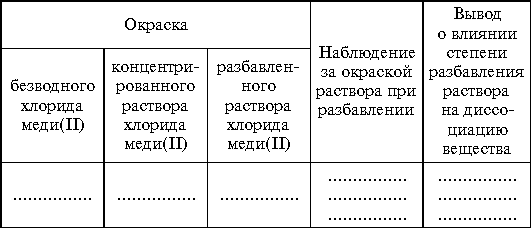
Задание 3. Рассмотреть безводную хлорную медь(II). Растворить небольшое ее количество в 1–2 мл воды, затем постепенно (no каплям) разбавить раствор. Выпарить раствор, следить за изменениями окраски.
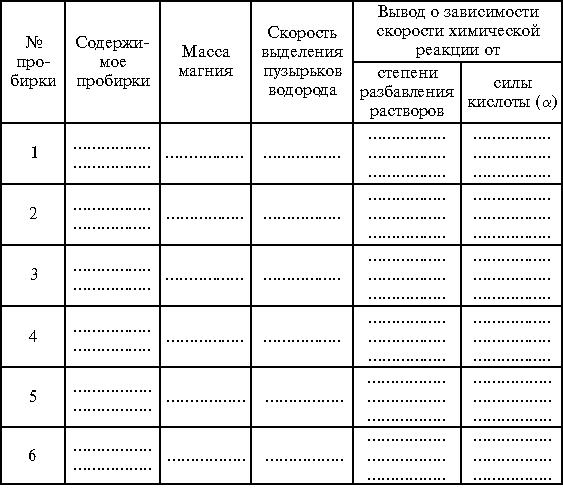
Задание 4. В первые три
пронумерованные пробирки влить по 2 мл соляной
кислоты ![]() =
1,19 г/см3),
=
1,19 г/см3),![]() = 80%). В
пробирки № 2 и 5 с соляной и уксусной кислотами
соответственно прилить по 1 мл воды, в пробирки №
3 и 6 – по 2 мл воды. Затем во все пробирки
присыпать по 1 г заранее приготовленных навесок
магниевого порошка. Внимательно следить за
признаками реакции и скоростью выделения
водорода в каждой из пробирок.
= 80%). В
пробирки № 2 и 5 с соляной и уксусной кислотами
соответственно прилить по 1 мл воды, в пробирки №
3 и 6 – по 2 мл воды. Затем во все пробирки
присыпать по 1 г заранее приготовленных навесок
магниевого порошка. Внимательно следить за
признаками реакции и скоростью выделения
водорода в каждой из пробирок.
Практическая работа 3.
Реакции обмена между электролитами
Цели. Закрепить знание условий
необратимости реакций ионного обмена между
растворами электролитов, рассмотреть влияние
концентрации реагентов и температуры на
направление реакции.
Оборудование и реактивы. Шпатель,
Г-образная газоотводная трубка с пробкой,
санитарная склянка, штатив с пробирками; мел
измельченный (CaCO3), растворы солей Fe2(SO4)3,
СaCl2, Al2(SO4)3, AgNO3, Na2SO3,
NaCl, Na2CO3, Na3PO4, Ba(NO3)2,
BaCl2, кристаллические соли Na2SO3, Na2CO3,
NaCl, HNO3 (конц.), H2SO4 (конц.), HCl
(разб.), H2SO4 (разб.), фенолфталеин
(спирт. р-р),
NaOH (разб. р-р), NaOH (конц. р-р), лакмусовая бумажка.
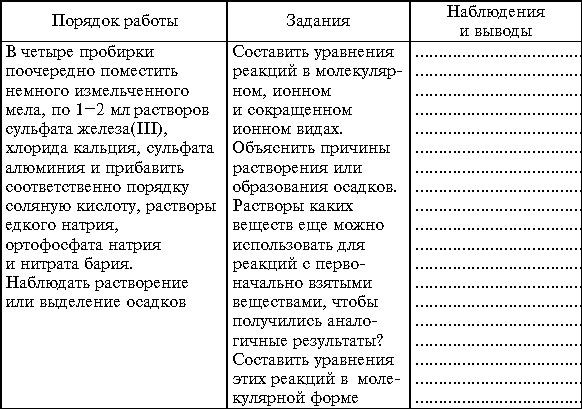

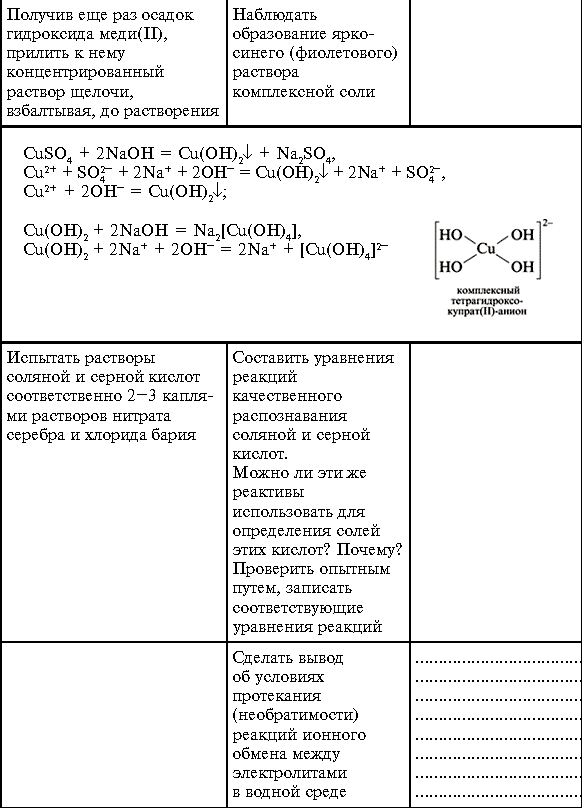
Практическая работа 4.
Амфотерные оксиды и гидроксиды
Цели. Обобщить, закрепить и углубить
знания о составах амфотерных оксидов и
гидроксидов.
Оборудование и реактивы. Спиртовка,
спички, держалка для пробирок, набор индикаторов,
штатив с пробирками, санитарная склянка; ZnO, HCl, NaOH
(крист.), NaOH (водн. р-р).
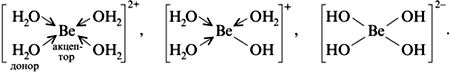
Реакции амфотерного оксида BeO
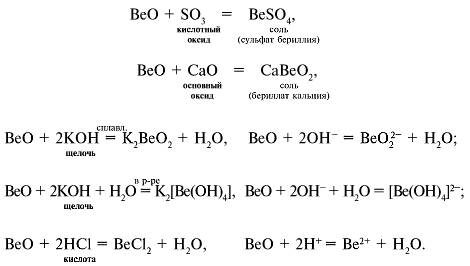
Реакции амфотерного гидроксида Be(OH)2 (H2BeO2)
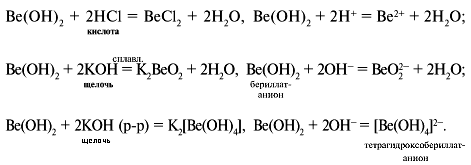
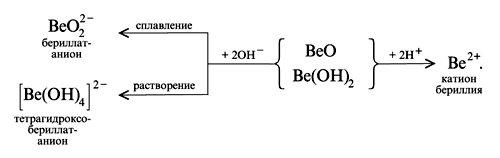
В водной щелочной среде одновременно существуют комплексные ионы, в которых во внутренней сфере комплекса находятся по четыре лиганда, т. к. координационное число катиона Be2+ равно четырем:

Строение внутренней сферы комплексных соединений.