УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК ЗАДАЧНИК ЗАДАЧНИК ЛАБОРАТОРНЫЙ ПРАКТИКУМ ЛАБОРАТОРНЫЙ ПРАКТИКУМ НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3,
4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28,
29, 30, 31, 32, 35, 36, 37, 39, 41/2003
§ 6.2. Общие свойства растворов
(окончание)
Лабораторные исследования
1. Сравнение температур кипения
растворителя и раствора без использования
термометра.
Для этого исследования вам понадобится всего три
маленьких химических стаканчика или колбочки.
В стаканчик с водой обязательно положите на дно
несколько «кипелок» – кусочки пемзы или кирпича.
Это сделать совершенно необходимо, иначе
жидкость может перегреться, потом взрывоподобно
закипеть, выплеснуться и обжечь вас или ваших
соседей.
Приготовьте растворы неэлектролита и
электролита, выбрав из предложенных веществ:
сахароза С12Н22О11, глюкоза С6Н12О6,
мочевина (карбамид) СО(NН2)2, хлорид
натрия NaCl, нитрат натрия NaNO3, сульфат натрия
Na2SО4, сульфат калия К2SO4,
хлорид алюминия AlCl3, сульфат алюминия Al2(SO4)3,
а также любое другое вещество, указанное
учителем.
Раствор можно приготовить, взяв на 10 мл примерно
2–3 г вещества. В стаканчик или колбочку налейте
отмеренное количество воды и добавьте изучаемое
вещество. Перемешайте раствор стеклянной
палочкой до его полного растворения. Если
вещество растворилось неполностью, слейте
раствор в другой стаканчик, а нерастворившийся
осадок сдайте учителю, написав на стаканчике
формулу вещества. Таким же образом приготовьте
второй раствор. Не забудьте в каждый стаканчик
поместить «кипелки».
Три стаканчика – с водой, растворами
неэлектролита и электролита – поставьте на
железную пластинку (раньше использовали
асбестированные сетки, но асбест очень вреден
для здоровья), лежащую на штативном кольце. Под
пластинкой поставьте газовую или спиртовую
горелку. Еще раз проверьте, в каждом ли
стаканчике лежат «кипелки». Очень удобно
воспользоваться электроплиткой. В любом случае
постарайтесь так расположить стаканчики, чтобы
они нагревались равномерно.
Опыт проводить в защитных очках или маске, под
тягой с закрытыми створками или за пластмассовым
прозрачным негорючим экраном.
Начинайте медленно нагревать все три стаканчика
и отмечайте последовательность закипания
жидкости в каждом из них, что позволит вам судить
о температуре начала кипения каждой жидкости.
Сделайте выводы по своему эксперименту, затем
соберите результаты опытов других учеников и
сформулируйте выводы по всему проведенному
исследованию.
2. Сравнение температур кипения воды и
раствора с использованием термометра.
Этот эксперимент проводят точно так же, как и
предыдущий, но вам понадобятся три термометра с
диапазоном измерения температур около 100 °С.
Желательно, чтобы термометры были не ртутными и
как можно более точными. Если в школьной
лаборатории имеются только ртутные термометры,
то эксперимент проводит учитель, а ученики
следят за показаниями термометров. На шарик
термометра наденьте кусочек резиновой трубки,
чтобы термометр не разбился о дно или стенку
стаканчика. Термометры закрепите в лапках
штатива. В стаканчиках должно быть столько
жидкости, чтобы в нее были полностью погружены
шарики термометра.
Медленно нагревайте стаканчики. При приближении
температуры к 100 °С через каждые 15 с
записывайте показания термометров. (Удобно
работать втроем и каждому ученику следить за
одним термометром.) После начала кипения
жидкости продолжайте снимать показания
термометра еще в течение 2–3 мин. Нарисуйте
график зависимости температуры жидкости от
времени ее нагревания.
Сформулируйте выводы. Постарайтесь
воспользоваться правилом фаз для объяснения
вида кривых.
3. Температура замерзания раствора.
Изучите охлаждение растворов следующих веществ
(один ученик изучает по указанию учителя
поведение трех веществ – воды, растворов
неэлектролита и электролита): сахароза С12Н22О11,
глюкоза С6Н12О6, мочевина
(карбамид) СО(NН2)2, хлорид натрия,
нитрат натрия, сульфат натрия, сульфат калия,
хлорид алюминия, сульфат алюминия. Учитель также
может предложить любое другое вещество.
Для эксперимента вам понадобится термометр с
диапазоном измерения температур около 0 °С.
Эксперимент проводится точно так же, как в
предыдущем опыте.
4. Осмос и осмотическое давление.
Посмотрите на прибор для определения
осмотического давления (см. рис. 6.7). Соберите
аналогичный прибор.
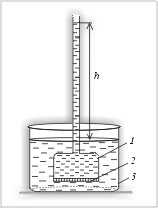
|
Рис. 6.7.
Прибор для определения
осмотического давления:
1 – сосуд с раствором;
2 – полупроницаемая перегородка;
3 – сосуд с растворителем
|
В качестве сосуда с раствором можно взять
обычную воронку, но на ее краях укрепить
полупроницаемую мембрану будет не очень просто.
Для этого можно воспользоваться широким
резиновым кольцом от велосипедной камеры. Узкая
часть воронки при помощи куска резинового шланга
удлиняется стеклянной трубкой.
Можно сосуд для раствора изготовить из широкой
стеклянной трубки диаметром около 5 см и длиной
4–6 см. Края трубки должны быть оплавлены. На один
конец этой трубки крепится мембрана, а во второй
конец вставляется пробка с отверстием для узкой
стеклянной трубки.
Очень удобно использовать верхнюю
воронкообразную часть бутылки. Трудность
состоит в том, чтобы ровно отрезать эту часть от
бутылки. Для этого следует нанести на желаемом
месте кольцевой надрез стеклорезом, резцом из
твердого сплава или даже краем сверла. При
прикосновении расплавленным концом раскаленной
стеклянной палочки к надрезу появляется
кольцевая трещина и бутылка разделяется на две
части. Обрезанный край обработать напильником,
чтобы не порезаться и не испортить мембрану. В
горло бутылки вставляется пробка с длинной
стеклянной трубкой.
Самый простой способ обнаружения осмотического
давления – это использовать мешочек из
полупроницаемой пленки, который укрепить на
конце стеклянной трубки. К сожалению,
осмотическое давление обнаруживается по уровню
раствора в этом опыте не скоро, т. к. мешочек
должен заполниться водой из внешнего сосуда,
стать упругим, и тогда только станет заметен
подъем уровня раствора в трубке. За проявлением
осмоса можно следить по изменению формы мешочка.
Очень трудным в этом эксперименте будет вопрос
о материале полупроницаемой мембраны. Наилучшая
мембрана получается из воздушного пузыря
крупной рыбы. Можно попробовать взять для
мембраны тончайшую пластмассовую пленку пакета
для упаковки пищевых продуктов или самую тонкую
пленку резинового детского воздушного шарика.
Во внутренний сосуд прибора налейте
концентрированный (для ускорения прохождения
опыта) раствор одного из следующих веществ:
сахароза С12Н22О11, глюкоза С6Н12О6,
мочевина (карбамид) СО(NН2)2, хлорид
натрия, нитрат натрия, сульфат натрия, сульфат
калия, хлорид алюминия, сульфат алюминия.
Можно использовать любое другое вещество по
указанию учителя.
Раствор должен заполнить полностью внутренний
сосуд, и уровень его находиться на 2–3 см выше
пробки со стеклянной трубкой. Раствор можно
подкрасить перманганатом калия или другим
веществом для лучшего наблюдения за подъемом
жидкости в трубке и, кроме того, легче будет
обнаружить утечку раствора через неплотности
соединений. Во внешний сосуд наливают чистую
воду и в него опускают сосуд с мембраной,
полностью погрузив его в воду.
Опыт довольно продолжителен, и требуется
несколько часов, чтобы уровень раствора в трубке
поднялся хотя бы на 10 см. Осмос будет тем быстрее
заметен, чем выше концентрация раствора, тоньше
пленка, больше площадь пленки, меньше диаметр
стеклянной трубки. Объясните причины. Очень
важно в этом опыте, чтобы не было никаких
неплотностей в соединениях пленки с внутренним
сосудом и в других местах прибора.
Использованную вами конструкцию прибора
зарисуйте в своем лабораторном журнале, опишите
эксперимент и сформулируйте выводы. Какое из
веществ показывает самое высокое осмотическое
давление?
О.С.ЗАЙЦЕВ
|
