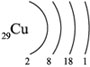
МЕДЬ И ЕЕ СОЕДИНЕНИЯУРОК В 11-м ЕСТЕСТВЕННО-НАУЧНОМ КЛАССЕДля повышения познавательной
активности и самостоятельности учащихся мы
используем уроки коллективного изучения
материала. На таких уроках каждый ученик (или
пара учеников) получает задание, о выполнении
которого он должен отчитаться на этом же уроке,
причем его отчет фиксируется остальными
учениками класса в тетрадях и является элементом
содержания учебного материала урока. Каждый
ученик вносит свою лепту в изучение темы классом. ХОД УРОКА Установочный этапУчитель ставит перед учащимися цель урока:
опираясь на имеющиеся знания о свойствах
веществ, спрогнозировать, подтвердить
практически, обобщить сведения о меди и ее
соединениях. Таблица Свойства меди и ее соединений
Этап самостоятельной работыДля подтверждения и дополнения предположений учащиеся выполняют лабораторные опыты по инструкции и записывают уравнения проведенных реакций.
Инструкции для самостоятельной работы парами
Этап обмена информацией и подведение итоговУчитель задает вопрос, касающийся свойств конкретного вещества. Учащиеся, выполнявшие соответствующие опыты, докладывают о проведенном эксперименте и записывают уравнения реакций на доске. Затем учитель и ученики дополняют сведения о химических свойствах вещества, которые невозможно было подтвердить реакциями в условиях школьной лаборатории. Порядок обсуждения химических свойств соединений меди 1. Как медь реагирует с кислотами, с какими еще веществами может реагировать медь? Записываются уравнения реакций меди с: • концентрированной и разбавленной азотной кислотой: Cu + 4HNO3 (конц.) = Cu(NO3)2
+ 2NO2 + 2H2O, • концентрированной серной кислотой: Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O; • кислородом: 2Cu + O2 = 2CuO; • хлором: Cu + Cl2 = CuCl2; • соляной кислотой в присутствии кислорода: 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O; • хлоридом железа(III): 2FeCl3 + Cu = CuCl2 + 2FeCl2. 2. Какие свойства проявляют оксид и хлорид меди(I)? Обращается внимание на осно'вные свойства, способность к комплексообразованию, окислительно-восстановительную двойственность. Записываются уравнения реакций оксида меди(I) с: • соляной кислотой до образования CuCl: Cu2O + 2HCl = 2CuCl + H2O; • избытком HCl: CuCl + HCl = H[CuCl2]; • реакций восстановления и окисления Cu2O: Cu2O + H2 = 2Cu + H2O, 2Cu2O + O2 = 4CuO; • диспропорционирования при нагревании: Cu2O = Cu + CuO, 3. Какие свойства проявляет оксид меди(II)? Обращается внимание на осно'вные и окислительные свойства. Записываются уравнения реакций оксида меди(II) с: • кислотой: CuO + 2H+ = Cu2+ + H2O; • этанолом: C2H5OH + CuO = CH3CHO + Cu + H2O; • водородом: CuO + H2 = Cu + H2O; • алюминием: 3CuO + 2Al = 3Cu + Al2O3. 4. Какие свойства проявляет гидроксид меди(II)? Обращается внимание на окислительные, осно'вные свойства, способность к комплексообразованию с органическими и неорганическими соединениями. Записываются уравнения реакций с: • альдегидом: RCHO + 2Cu(OH)2 = RCOOH + Cu2O + 2H2O; • кислотой: Cu(OH)2 + 2H+ = Cu2+ + 2H2O; • аммиаком: Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2; • глицерином:
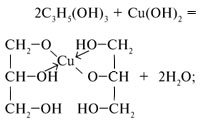
• уравнение реакции разложения: Cu(OH)2 = CuO + H2O. 5. Какие свойства проявляют соли меди(II)? Обращается внимание на реакции ионного обмена, гидролиза, окислительные свойства, комплексообразование. Записываются уравнения реакций сульфата меди с: • гидроксидом натрия: Cu2+ + 2OH– = Cu(OH)2; • фосфатом натрия: 3Cu2+ + 2 • цинком: Cu2+ + Zn = Cu + Zn2+; • йодидом калия: 2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4; • аммиаком: Cu2+ + 4NH3 = [Cu(NH3)4]2+; и уравнения реакций: • гидролиза: Cu2+ + HOH = CuOH+ + H+; • совместного гидролиза с карбонатом натрия с образованием малахита: 2Cu2+ + 2 В дополнение можно рассказать учащимся о взаимодействии оксида и гидроксида меди(II) с щелочами, что доказывает их амфотерность: Cu(OH)2 + 2NaOH (конц.) = Na2[Cu(OH)4], CuO + Na2O = Na2CuO2 (при 800–1000°С).
Оставшееся время урока можно потратить на выполнение упражнений и решение расчетных задач. Упражнение 1. Осуществите цепочку превращений: Cu Упражнение 2. Предложите не менее восьми способов получения хлорида меди(II).
Cu + Cl2 = CuCl2, Cu + HgCl2 = CuCl2 + Hg, 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O, CuO + 2HCl = CuCl2 + H2O, Cu(OH)2 + 2HCl = CuCl2 + 2H2O, CuBr2 + Cl2 = CuCl2 + Br2, (CuOH)2CO3 + 4HCl = 2CuCl2 + 3H2O + CO2, 2CuCl + Cl2 = 2CuCl2, 2CuCl = CuCl2 + Cu, CuSO4 + BaCl2 = CuCl2 + BaSO4.) Упражнение 3. Составьте цепочки превращений, соответствующие следующим схемам, и осуществите их:
Задача 1. Сплав меди с алюминием
обработали сначала избытком щелочи, а затем
избытком разбавленной азотной кислоты.
Вычислите массовые доли металлов в сплаве, если
известно, что объемы газов, выделившихся в обеих
реакциях (при одинаковых условиях), равны между
собой (Ответ. Массовая доля меди – 84%.) Задача 2. При прокаливании 6,05 г кристаллогидрата нитрата меди(II) получено 2 г остатка. Определите формулу исходной соли [2, с. 204, № 836]. (Ответ. Cu(NO3)2 • 3H2O.) Задача 3. Медную пластинку массой 13,2 г опустили в 300 г раствора нитрата железа(III) с массовой долей соли 0,112. Когда ее вынули, оказалось, что массовая доля нитрата железа(III) стала равной массовой доле образовавшейся соли меди(II). Определите массу пластинки после того, как ее вынули из раствора [2, с. 204, № 841]. (Ответ. 10 г.) Домашнее задание. Выучить материал, записанный в тетради. Составить цепочку превращений по соединениям меди, содержащую не менее десяти реакций, и осуществить ее. ЛИТЕРАТУРА1. Пузаков С.А., Попков В.А. Пособие по
химии для поступающих в вузы. Программы. Вопросы,
упражнения, задачи. Образцы экзаменационных
билетов. М.: Высшая школа, 1999, 575 с. В.Г.ДЕНИСОВА,
|